Proses elektrolisis adalah topik yang terkait dengan bidang ilmu kimia dan elektrokimia, yaitu cabang ilmu kimia yang mempelajari hubungan antara reaksi kimia dan arus listrik. Di dalam arus listrik ini, Anda akan mengenal tentang apakah anoda positif atau negatif.
Dalam mempelajari tentang cabang ilmu kimia ini, Anda perlu memahami tentang apa itu proses elektrolisis, kapan anoda bermuatan positif atau negatif, dan bagaimana cara kerjanya. Jadi, simak penjelasan lengkapnya di sini!
Proses Elektrolisis
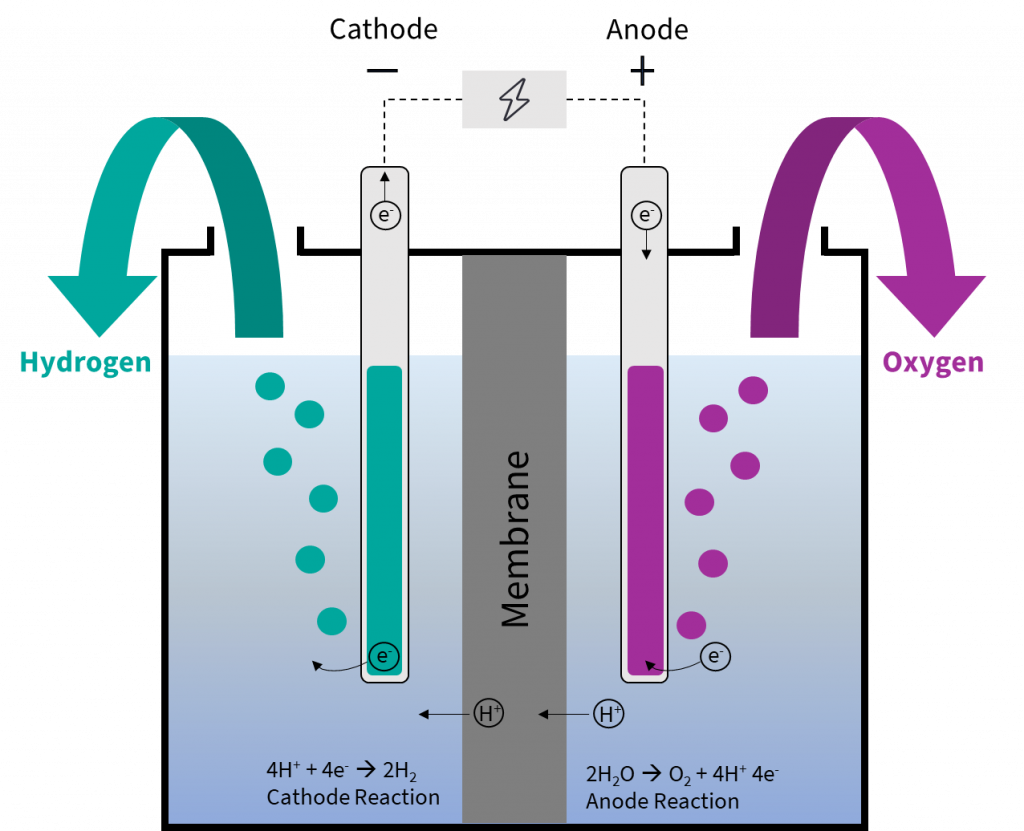
Proses elektrolisis adalah metode yang menggunakan arus listrik untuk menyebabkan reaksi kimia nonspontan (reaksi yang tidak terjadi secara alami) terjadi dalam larutan elektrolit. Ini melibatkan penggunaan dua elektroda (katoda dan anoda) yang terendam dalam larutan elektrolit.
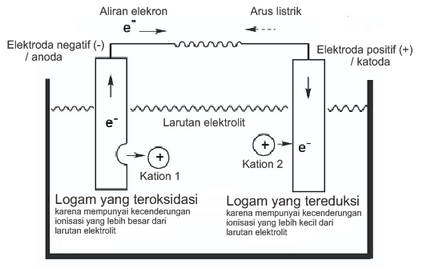
Ketika arus listrik melewati larutan elektrolit, reaksi redoks terjadi di elektroda-elektroda tersebut. Pada anoda, terjadi reaksi oksidasi dimana zat teroksidasi kehilangan elektron dan menjadi ion atau molekul yang bermuatan positif.
Pada katoda, terjadi reaksi reduksi dimana zat tereduksi menerima elektron dan menjadi ion atau molekul yang bermuatan negatif.
Proses elektrolisis memiliki berbagai aplikasi, termasuk pengolahan logam, elektroplating, produksi bahan kimia, pemisahan unsur-unsur dalam senyawa, dan banyak lagi.
Anoda Positif atau Negatif dalam Proses Elektrolisis
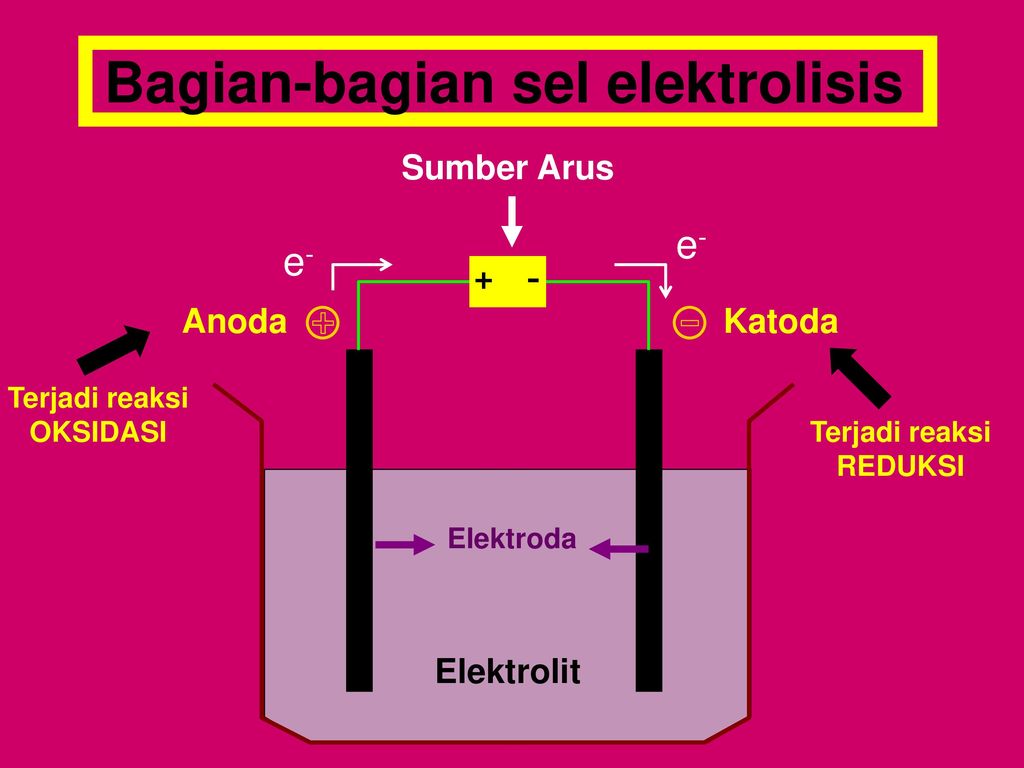
Dalam proses elektrolisis, anoda dapat menjadi positif atau negatif tergantung pada jenis sel elektrolisis yang digunakan. Namun, umumnya anoda memiliki muatan positif dalam proses elektrolisis. Anoda dengan muatan positif ini berfungsi sebagai tempat terjadinya reaksi oksidasi.
Dalam proses elektrolisis, anoda memiliki peran penting. Anoda adalah elektroda yang terhubung ke terminal positif sumber listrik. Dalam kasus ini, apakah terbentuk anoda positif atau negatif? Maka jawabannya adalah anoda akan memiliki muatan positif.
Pada anoda yang mengalami reaksi oksidasi, zat yang ada di anoda kehilangan elektron dan berubah menjadi ion atau molekul bermuatan positif. Reaksi oksidasi ini memungkinkan pemisahan dan transformasi zat di anoda selama proses elektrolisis.
Selain itu, anoda juga berfungsi sebagai tempat keluarnya elektron menuju sirkuit eksternal. Elektron-elektron ini bergerak dari anoda melalui kabel dan sirkuit eksternal, yang kemudian menuju katoda.
Singkatnya, anoda menyediakan muatan positif dan memfasilitasi reaksi oksidasi yang diperlukan dalam proses elektrolisis.
Hal ini memungkinkan pemisahan dan transformasi zat di anoda, sementara elektron-elektron yang terlepas dari reaksi oksidasi digunakan untuk mempertahankan aliran arus listrik.
Perbedaan Katoda dan Anoda
Seperti yang telah disebutkan sebelumnya bahwa katoda dan anoda merupakan istilah penting dalam proses elektrolisis. Maka, perbedaan antara anoda dan katoda dapat dilihat dari beberapa indikator, yaitu:
- Polaritas: Anoda memiliki polaritas positif, sementara katoda memiliki polaritas negatif. Dalam proses elektrokimia, arus listrik mengalir dari anoda ke katoda.
- Reaksi Elektrokimia: Reaksi oksidasi terjadi di anoda dan membentuk ion positif atau senyawa yang lebih tinggi dalam keadaan oksidasi. Di sisi lain, reaksi reduksi terjadi di katoda, di mana ion positif mengalami reduksi.
- Muatan Listrik: Anoda memiliki muatan positif, sedangkan katoda memiliki muatan negatif. Ini disebabkan oleh transfer elektron dari anoda ke katoda selama proses elektrokimia. Jadi, anoda positif atau negatif (katoda) adalah dua hal yang berbeda dari segi fungsi.
- Tempat Terjadinya Reaksi: Anoda adalah tempat terjadinya reaksi oksidasi, dimana zat di anoda kehilangan elektron. Sementara itu, katoda adalah tempat terjadinya reaksi reduksi, dimana zat di katoda menerima elektron.
- Koneksi Listrik: Anoda umumnya dihubungkan ke terminal positif dari suatu sumber listrik, sementara katoda dihubungkan dengan terminal negatif. Ini memungkinkan aliran arus listrik dari anoda ke katoda selama proses elektrokimia.
Perbedaan-perbedaan ini menggambarkan peran dan sifat unik anoda dan katoda dalam proses elektrokimia. Kedua elektroda ini bekerja bersama-sama untuk menjaga keseimbangan muatan dan memfasilitasi reaksi redoks yang terjadi selama elektrolisis atau sel elektrokimia.
Prinsip Kerja Elektrolisis
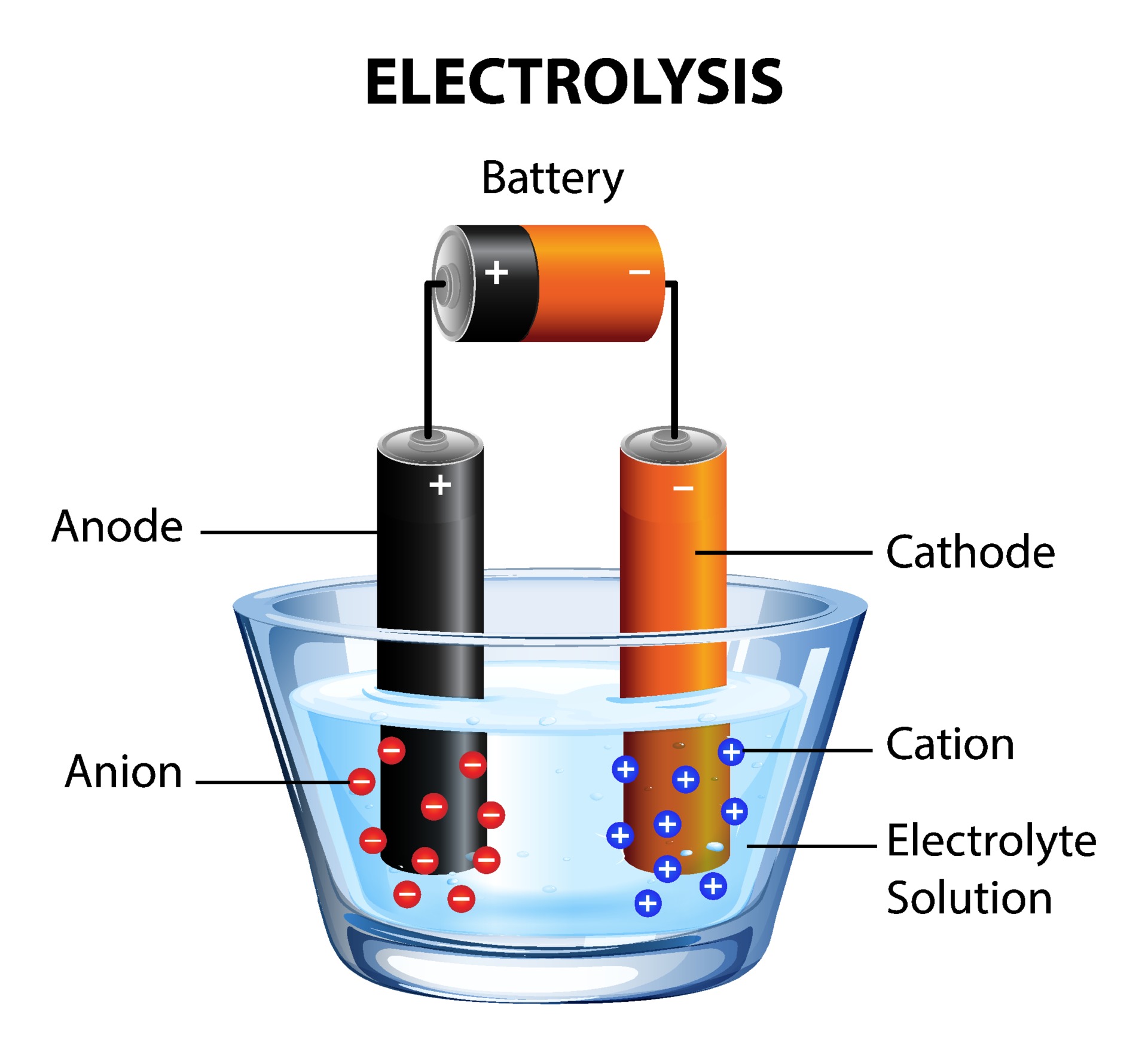
Prinsip kerja elektrolisis didasarkan pada penerapan arus listrik ke dalam larutan elektrolit atau cairan elektrolit padat. Proses ini melibatkan dua elektroda yang terendam dalam larutan elektrolit, yaitu anoda (elektroda positif) dan katoda (elektroda negatif).
Prinsip kerja elektrolisis dapat dijelaskan melalui beberapa langkah berikut:
1. Pengaturan Sel Elektrolisis
Elektroda-anoda dan katoda ditempatkan dalam larutan elektrolit yang memungkinkan terjadinya konduksi ion. Larutan elektrolit ini dapat berupa larutan garam, asam, atau elektrolit lainnya.
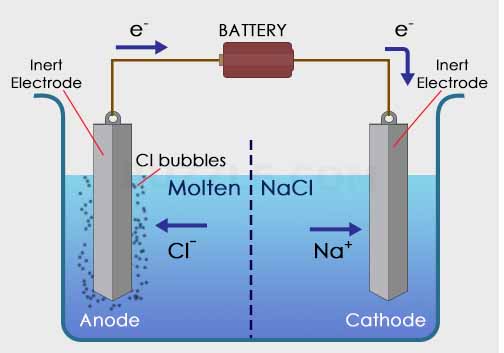
Contoh larutan elektrolit adalah natrium klorida (NaCl), asam seperti asam sulfurik (H2SO4), atau larutan kalium hidroksida (KOH). Komposisi dan konsentrasi larutan elektrolit dapat disesuaikan sesuai dengan kebutuhan eksperimen atau aplikasi elektrokimia tertentu.
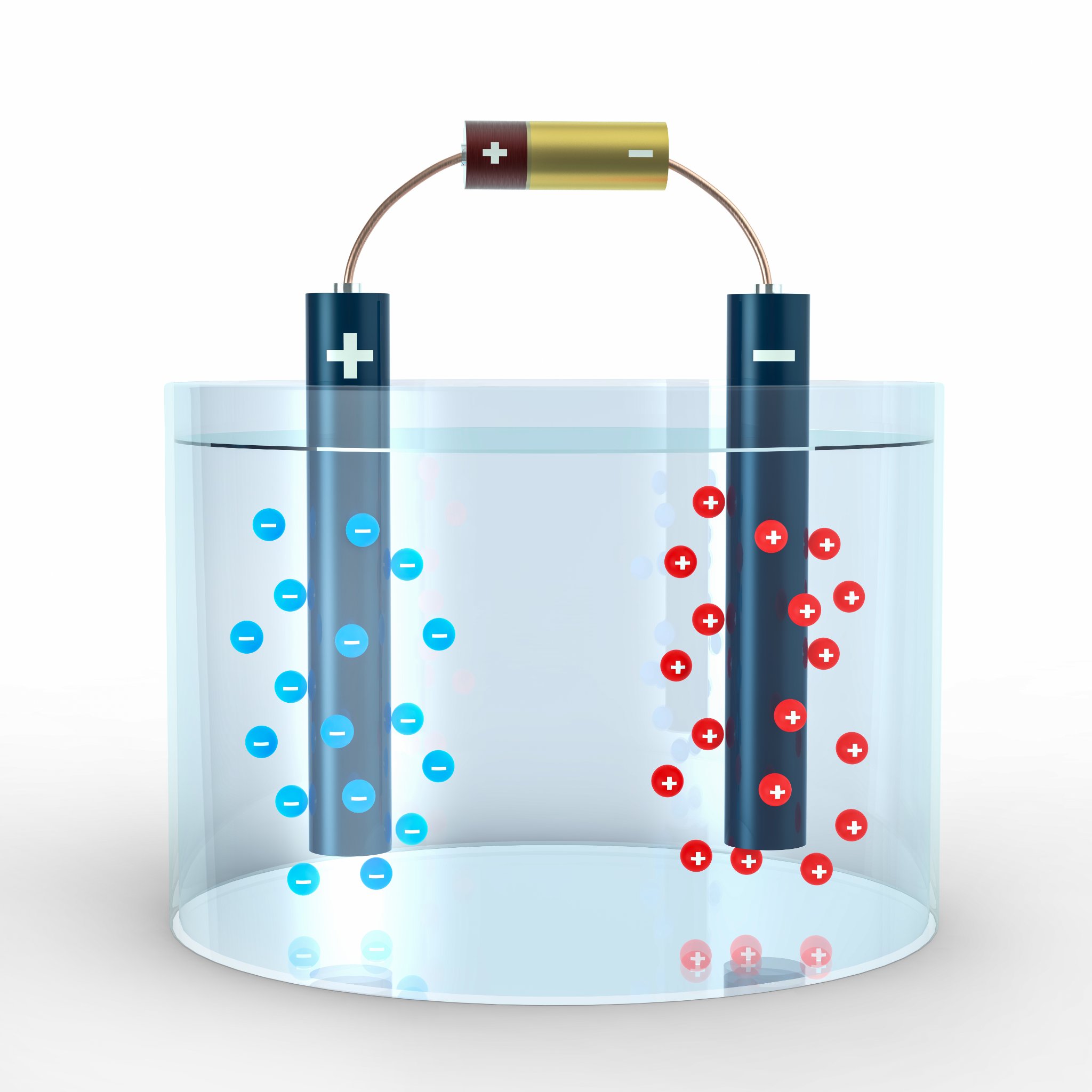
Ketika elektroda-anoda dan katoda dicelupkan ke dalam larutan elektrolit, ion-ion dalam larutan akan bergerak dan membawa muatan listrik. Larutan elektrolit mengandung ion positif (kation) dan ion negatif (anion) yang saling bergerak bebas dalam larutan.
2. Penerapan Arus Listrik
Untuk menjalankan proses elektrolisis, arus listrik dialirkan melalui elektroda-anoda dan katoda menggunakan sumber listrik eksternal seperti baterai, catu daya, atau generator. Sumber listrik ini menyediakan energi yang diperlukan untuk mempertahankan aliran arus selama proses elektrolisis.
Elektroda-anoda terhubung ke terminal positif sumber listrik, sementara elektroda-katoda terhubung ke terminal negatif. Dalam konfigurasi ini, terjadi perbedaan potensial antara elektroda-anoda dan katoda, sehingga memungkinkan aliran arus listrik melalui larutan elektrolit.
Muatan positif pada elektroda-anoda ditarik oleh muatan negatif pada elektroda-katoda, menciptakan medan listrik yang mendorong ion-ion dalam larutan elektrolit untuk bergerak sesuai dengan arah arus.
Arus listrik kemudian mengalir dari elektroda-anoda melalui larutan elektrolit ke elektroda-katoda.
3. Reaksi Redoks di Anoda dan Katoda
Pada anoda, reaksi oksidasi terjadi. Zat yang ada di anoda kehilangan elektron dan berubah menjadi ion atau molekul yang bermuatan positif. Elektron-elektron yang terlepas dari zat tersebut diserap oleh elektroda-anoda.
Pada katoda, reaksi reduksi terjadi. Zat yang ada di katoda menerima elektron yang disediakan oleh elektroda-katoda dan berubah menjadi ion atau molekul yang bermuatan negatif.
Kedua reaksi inilah yang akan membentuk anoda positif atau negatif di dalam suatu proses elektrolisis. Namun, perlu diperhatikan bahwa elektroda dengan muatan positif disebut sebagai anoda, sementara yang bermuatan negatif disebut katoda.
4. Pemisahan Zat
Akibat reaksi redoks yang terjadi di anoda dan katoda, zat dalam larutan elektrolit dapat mengalami pemisahan atau transformasi. Misalnya, logam dapat terdeposisi pada katoda selama elektrolisis logam, atau senyawa dapat terurai menjadi unsur-unsur komponennya.
Prinsip kerja elektrolisis memanfaatkan arus listrik untuk memicu reaksi redoks yang tidak spontan dan memungkinkan pemisahan, pemurnian, atau transformasi zat dalam larutan elektrolit. Hal ini memungkinkan implementasi di berbagai bidang, seperti industri kimia, pengolahan logam, dll.
Dalam proses elektrolisis sendiri, anoda positif atau negatif sering menjadi topik pembahasan. Namun, pada dasarnya sebuah anoda memiliki muatan positif dan elektroda dengan muatan negatif disebut dengan katoda.
Kedua istilah ini memang agak sedikit membingungkan jika tidak ditelaah dengan baik. Namun, peran anoda maupun katoda dalam proses elektrolisis sangat penting, baik sebagai tempat terjadinya reaksi oksidasi maupun sebagai sumber muatan.