Hukum Boyle adalah salah satu teorema penting dalam ilmu Fisika yang membahas mengenai hubungan antara tekanan gas dengan volume dari gas tersebut. Hukum ini sangat penting untuk dipelajari karena memiliki banyak kegunaan dan aplikasi di kehidupan sehari-hari.
Kegiatan bernapas yang terjadi secara alami ternyata ada hubungannya dengan hukum tekanan dan volume gas. Ketika menarik napas dan mengeluarkan, maka volume paru-paru akan mengembang serta mengempis. Volume paru-paru yang berubah akan mempengaruhi tekanan paru-paru.
Pengertian dan Bunyi Hukum Boyle
Teorema Boyle dirumuskan oleh seorang ilmuwan di tahun 1662 bernama Robert Boyle. Robert Boyle melaksanakan serangkaian uji coba di dalam laboratorium untuk melihat bagaimana pengaruh tekanan terhadap volume fluida gas di dalam ruangan tertutup.
Untuk melaksanakan penelitiannya, Robert Boyle menjaga agar suhu di dalam ruangan tersebut tidak berubah atau konstan agar tidak terjadi reaksi kimia.
Dari penelitian oleh Robert Boyle ini maka dirumuskanlah teorema Boyle yang membahas mengenai hubungan antara tekanan absolut fluida gas di ruang tertutup terhadap volumenya.
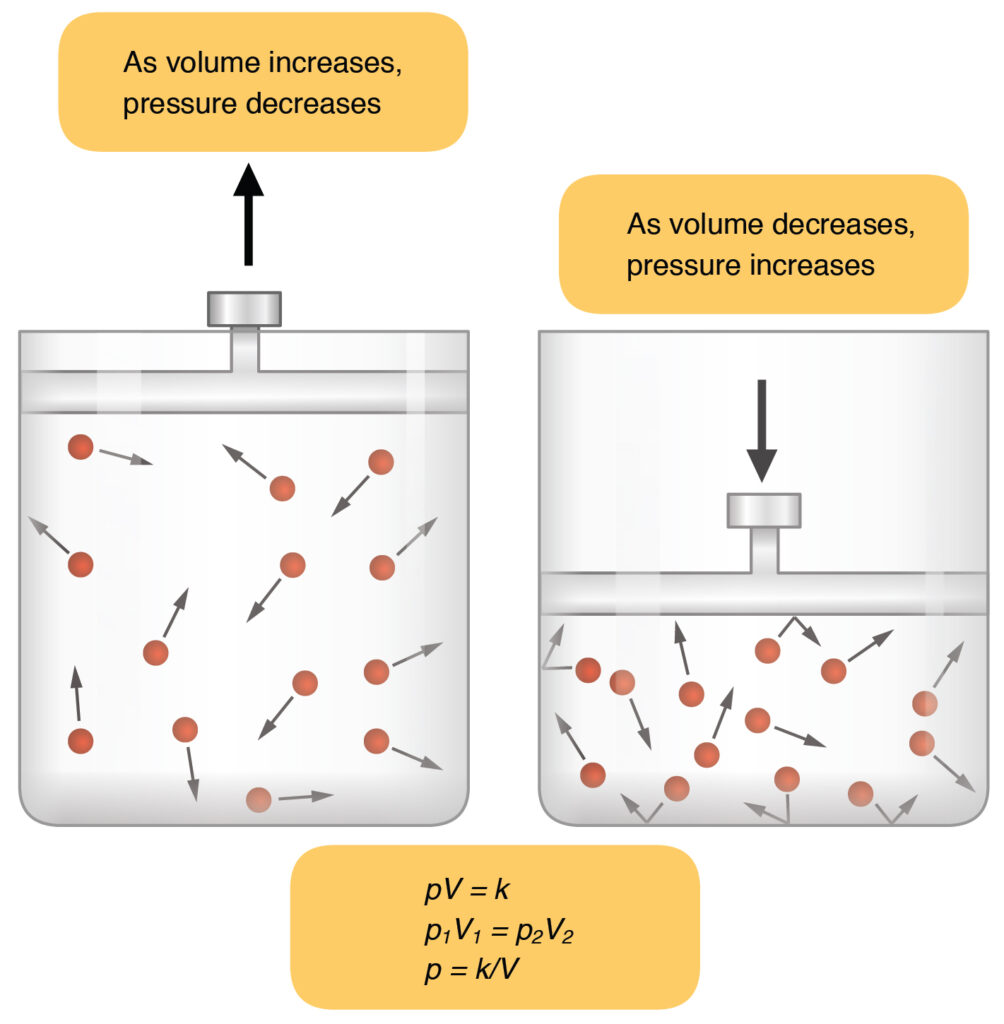
Hukum Boyle berbunyi bahwa tekanan gas di ruangan tertutup yang suhunya dijaga agar tetap konstan berbanding terbalik dari volume fluida gas di ruangan tersebut. Jadi jika tekanan gas ruangan menurun, maka volume gasnya bertambah.
Sementara jika tekanan gas ruangan meningkat, maka volume gasnya menurun. Pada ruangan dengan kondisi yang sama, maka nilai kali antara volume gas dan tekanan gas akan bernilai tetap.
Hukum yang dirumuskan Robert Boyle ini dikenal sebagai hukum gas ideal umum karena hanya berlaku pada ruangan tertutup bersuhu tetap.
Rumus
Rumus hukum Boyle berupa perkalian antara tekanan fluida gas dan volume yang ada di ruangan tertutup sehingga menghasilkan konstanta bernilai tetap. Ada 4 persyaratan agar teorema Boyle berlaku, yakni:
- Gas diamati di dalam ruangan tertutup
- Suhu ruangan tertutup dijaga tetap
- Reaksi kimia tidak terjadi di dalam ruangan
- Wujud dari fluida gas tidak berubah
P x V = C (bernilai tetap)
P1 x V1 = P2 x V2
Keterangan:
P1 = tekanan fluida gas awal (N/m² atau Pa atau atm.cm Hg)
P2 = tekanan fluida gas akhir (N/m² atau Pa atau atm.cm Hg)
V1 = volume gas awal (m³)
V2 = volume gas akhir (m³)
Contoh Penerapan dalam Kehidupan Sehari-hari
Dalam kehidupan sehari-hari, aktivitas manusia sangat dipengaruhi oleh udara dan gas di sekitarnya. Oleh karena itu, Anda bisa menemukan berbagai penerapan hukum ini termasuk aplikasi hukum Boyle dalam industri. Berikut adalah contoh penerapan di kehidupan sehari-hari:
1. Pemakaian Jarum Suntik
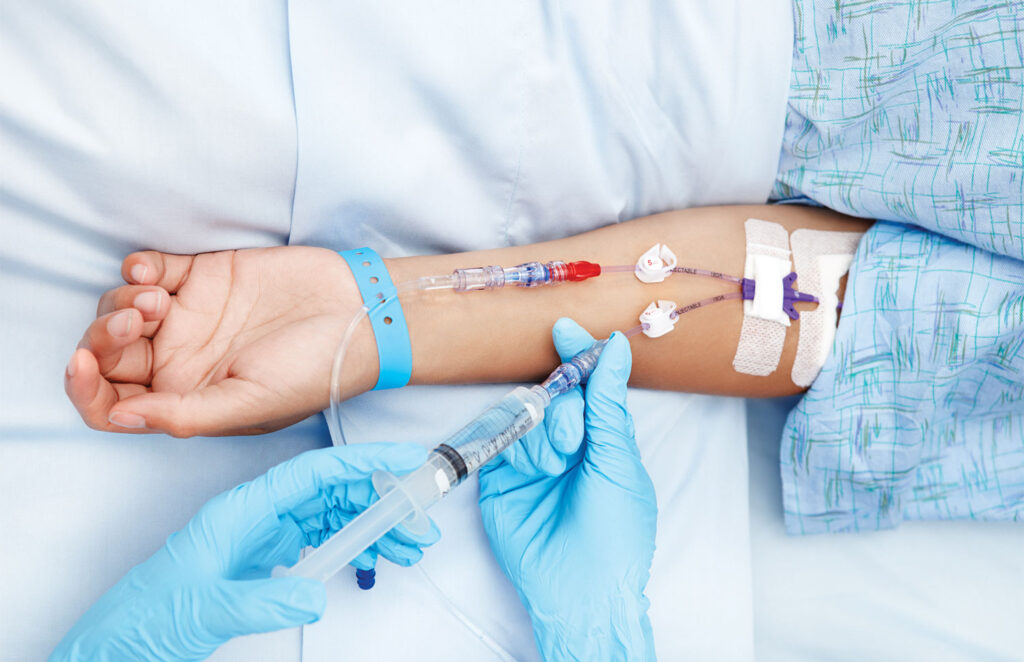
Pemakaian jarum suntik terutama di bidang medis sudah sangat lumrah. Namun, tidak banyak yang tahu bahwa ternyata penggunaan jarum suntik terkait erat dengan hukum ini. Prinsip kerja jarum suntik yakni tekanan pada alat suntik akan berubah tatkala plunger ditarik ke atas dari spuitnya.
Volume di dalam jarum suntik akan meningkat ketika plunger ditarik ke atas sementara tekanannya akan menurun. Alhasil, jarum suntik akan menarik cairan di luar yang memiliki tekanan lebih tinggi untuk masuk ke dalam ruang di dalam jarum suntik yang bertekanan lebih rendah.
Saat plunger ditekan, volume fluida di dalam silinder jarum suntik menurun sehingga tekanan meningkat dan cairan di dalamnya ke luar.
2. Mengisi Udara ke Dalam Ban

Contoh aplikasi hubungan antara tekanan dan volume gas berikutnya adalah pengisian udara ke dalam ban. Ketika ban kendaraan seperti sepeda diisi udara, maka udara yang masuk ke dalam ban tersebut adalah udara terkompresi yang memiliki tekanan 30 hingga 35 PSI.
Semakin banyak udara yang dipompa masuk ke dalam ban, maka molekul gas tersebut akan lebih banyak yang dipaksa memenuhi ruang dalam ban secara bersamaan.
Ketika jumlah molekul gas yang memenuhi ruang ban semakin banyak maka volumenya akan menurun. Sementara tekanan udara yang mendesak dinding ban semakin besar sehingga ketika ban dipegang akan terasa keras.
3. Sistem Pernapasan Manusia
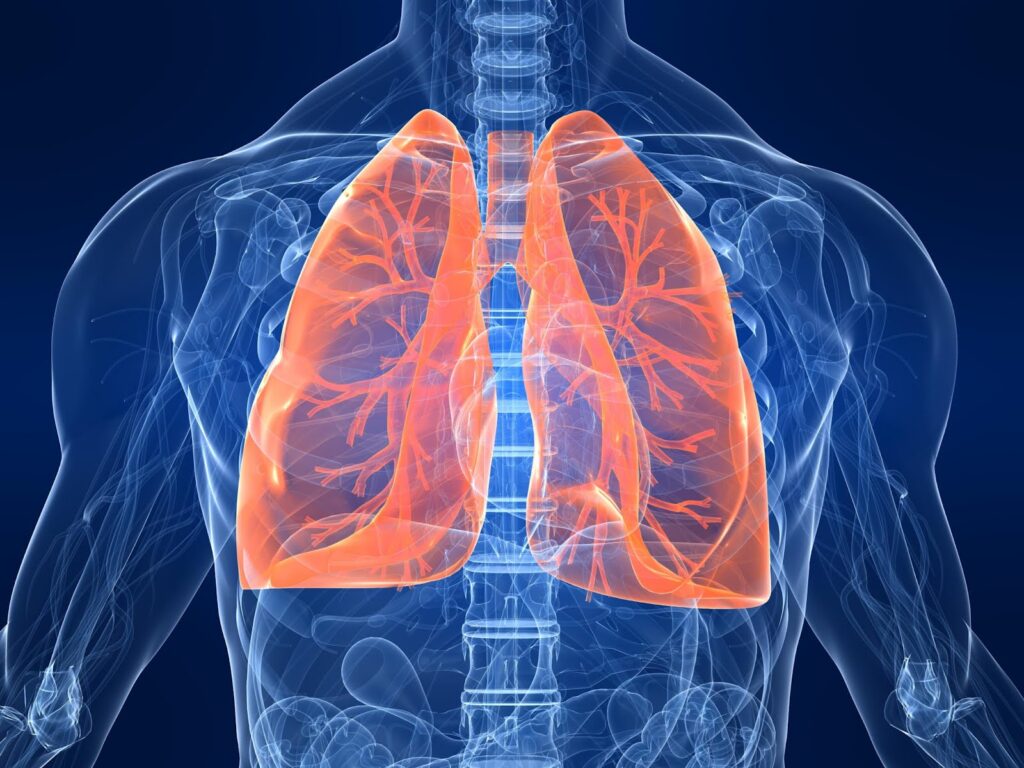
Secara alami, hukum yang membahas hubungan antara tekanan dan volume fluida gas bisa ditemukan pada sistem pernapasan manusia. Selama proses respirasi berlangsung, volume udara di dalam paru-paru akan meningkat saat menarik napas.
Hal ini membuat paru-paru mengembang dan tekanan di dalamnya menurun. Ketika seseorang menghembuskan napas, maka paru-paru akan mengurangi volume udara di dalamnya sehingga paru-paru mengempis. Tekanan di dalam paru-paru pun akan meningkat.
4. Pemanfaatan Cat Semprot

Cat semprot merupakan salah satu bentuk aplikasi hukum tekanan dan volume gas ruang tertutup yang banyak digunakan pada industri manufaktur, konstruksi dan lainnya. Terlepas dari jenis kaleng aerosol yang dipakai, kesemuanya memanfaatkan prinsip Boyle.
Kaleng aerosol sebelum disemprotkan harus dikocok terlebih dulu. Tujuan kaleng dikocok beberapa saat adalah agar fluida gas di dalam kaleng menyebar. Zat yang ada di dalam kaleng terdiri dari produk cat serta gas bertekanan dalam bentuk cair.
Gas berbentuk cair tersebut mempunyai titik didih yang sangat rendah, jauh di bawah suhu kamar. Oleh karena itu kaleng harus disegel rapat untuk mencegah gas mendidih. Ketika nozzle kaleng cat ditekan, maka cat di dalam kaleng akan tertekan dan keluar dari nozzle.
Kumpulan Soal dan Penjelasan

Di bawah ini adalah contoh soal hukum Boyle beserta jawabannya untuk memudahkan Anda memahami penerapan hukum ini dalam kehidupan sehari-hari.
1. Soal 1
Diketahui fluida gas di dalam ruangan tertutup mempunyai volume udara sebesar 300 mL. Ruangan tersebut dijaga suhunya agar tidak berubah dengan tekanan yang diketahui sebesar 50 cmHg.
Jika volume fluida gas menurun menjadi 250 mL, hitunglah berapa tekanan gas yang ada di dalam ruangan tertutup tersebut sekarang?
Diketahui:
V1 = 300 mL
P1 = 50 cmHg
V2 = 250 mL
Ditanya: Tekanan fluida gas sekarang (P2)?
Jawab:
Untuk menghitung berapakah tekanan fluida gas dengan volume gas yang berubah, menggunakan persamaan di bawah ini:
P1 x V1 = P2 x V2
P2 = (P1 x V1) : V2
P2 = (50 x 300) : 250
P2 = 60 cmHg
2. Soal 2
Suatu ruangan tertutup diketahui memiliki tekanan udara sebesar 55.000 Pa, sementara volume gas di dalam ruangan tersebut sebesar 0,25 m³. Untuk mencegah terjadinya reaksi kimia di dalam ruangan tertutup. suhu di dalam ruangan tersebut dijaga untuk tetap konstan.
Hitunglah berapa besar volume di dalam ruangan apabila tekanan gas di dalam ruangan diubah menjadi 100.000 Pa?
Diketahui:
V1 = 0,25 m³
P1 = 55.000 Pa
P2 = 100.000 Pa
Ditanya: Besar volume di dalam ruangan (V2)?
Jawab:
P1 x V1 = P2 x V2
V2 = (P1 x V1) / P2
V2 = (55.000 x 0,25) / 100.000
V2 = 0,1375 m³
Hukum Boyle membahas mengenai sifat fluida gas yang ada di dalam ruangan tertutup. Hukum ini akan menunjukkan hubungan antara tekanan dan volume gas yang berbanding terbalik.
Ketika volume meningkat maka tekanan udara pun menurun. Sementara jika volume turun maka tekanan akan meningkat.