Hukum faraday masih menjadi istilah yang asing bagi sebagian orang. Istilah ini sering disebut ketika seseorang sedang membahas tentang kemajuan listrik. Sama halnya seperti hukum fisika jenis lainnya, jenis hukum fisika ini juga memiliki prinsip kerja dan sejarahnya tersendiri.
Maka dari itu, orang-orang yang ingin mengenal tentang istilah ini secara lebih jauh lagi, mereka harus mengetahui tentang pengertian, sejarah, fungsi, prinsip kerja, dan rumusnya dengan baik. Untuk mengetahui tentang semua hal itu, Anda bisa menyimak isi artikel ini sampai akhir!
Pengertian Hukum Faraday
Pengertian sederhana dari istilah ini adalah salah satu hukum fisika yang memberikan pengaruh besar terhadap kemajuan listrik dan ditemukan oleh seorang ahli bernama Michael Faraday.
Hukum fisika ini tidak hanya digunakan dalam ilmu fisika saja, tapi terkadang juga digunakan dalam ilmu kimia.
Sebab, hukum faraday adalah salah satu hukum fisika dan kimia yang didalamnya menjelaskan tentang hubungan antara jumlah penggunaan listrik pada suatu periode, dengan massa zat yang dihasilkan. Jadi, dapat dipastikan bahwa hukum ini tidak hanya berpusat pada dunia fisika saja.
Michael Faraday menciptakan generator listrik pada masanya dengan tujuan untuk memenuhi kebutuhan manusia. Selain itu, penciptaan generator listrik oleh Michael Faraday ini juga dilakukan sebagai penemuan induksi elektromagnetik yang cukup penting.
Pada saat itu, dijelaskan bahwa ada penemuan yang berkaitan dengan aspek kuantitatif dalam elektrolisis, dan dari penemuan tersebut menghasilkan 2 hukum elektrolisis Faraday yang sangat dikenal sampai saat ini. Sementara untuk beberapa jenis aspek kuantitatif yang dimaksud adalah:
- Massa zat hasil
- Volume gas
- Waktu elektrolisis yang dibutuhkan
- Jumlah mol elektron kuat arus
Prinsip Kerja Hukum Faraday
Selama proses penemuan hukum fisika dan kimia ini, Michael Faraday melihat setiap atom yang dihasilkan dibawa oleh suatu mol elektron yang ada di dalamnya. Tak menyia-nyiakan momen penting itu begitu saja, Michael Faraday langsung mengamati perubahan tersebut selama proses elektrolisis.
Kemudian, penemuan ini menghasilkan konstanta yang bermanfaat untuk menghitung jumlah muatan yang ada di dalam satu mol elektron. Jadi, orang-orang bisa lebih mudah untuk menghitung stoikiometri. Selain itu, jenis hukum fisika ini juga memiliki prinsip kerja khusus, yaitu:
1. Hukum Faraday I
Di dalam prinsip kerja yang satu ini dijelaskan bahwa suatu massa zat yang dilarutkan memiliki hasil yang berbanding lurus dengan muatan yang dilewati dalam sel. Tidak hanya itu, hasil dari massa zat ini juga bisa berbanding lurus dengan massa ekivalen dari zat yang dilarutkan tersebut.
Untuk lebih jelasnya, prinsip kerja yang pertama ini mengatakan bahwa massa zat yang dihasilkan dari elektroda selama elektrolisis dijalankan memiliki jumlah muatan listrik yang sama. Dengan begitu, bisa dipastikan bahwa massa produk yang dilarutkan pada elektroda bisa lebih banyak.
Nantinya, prinsip kerja dari hukum fisika ini memiliki rumus tersendiri yang harus diketahui oleh setiap individu, dan rumus tersebut adalah:
W = e . i . t/F
Keterangan:
W: Massa zat yang dihasilkan dengan menggunakan ketentuan gram
e: Ekuivalen
i: Kuat arus dengan menggunakan ketentuan ampere
t: Waktu dengan menggunakan ketentuan sekon
F: Tetapan Faraday yang berjumlah 96.500 Coulomb/mol
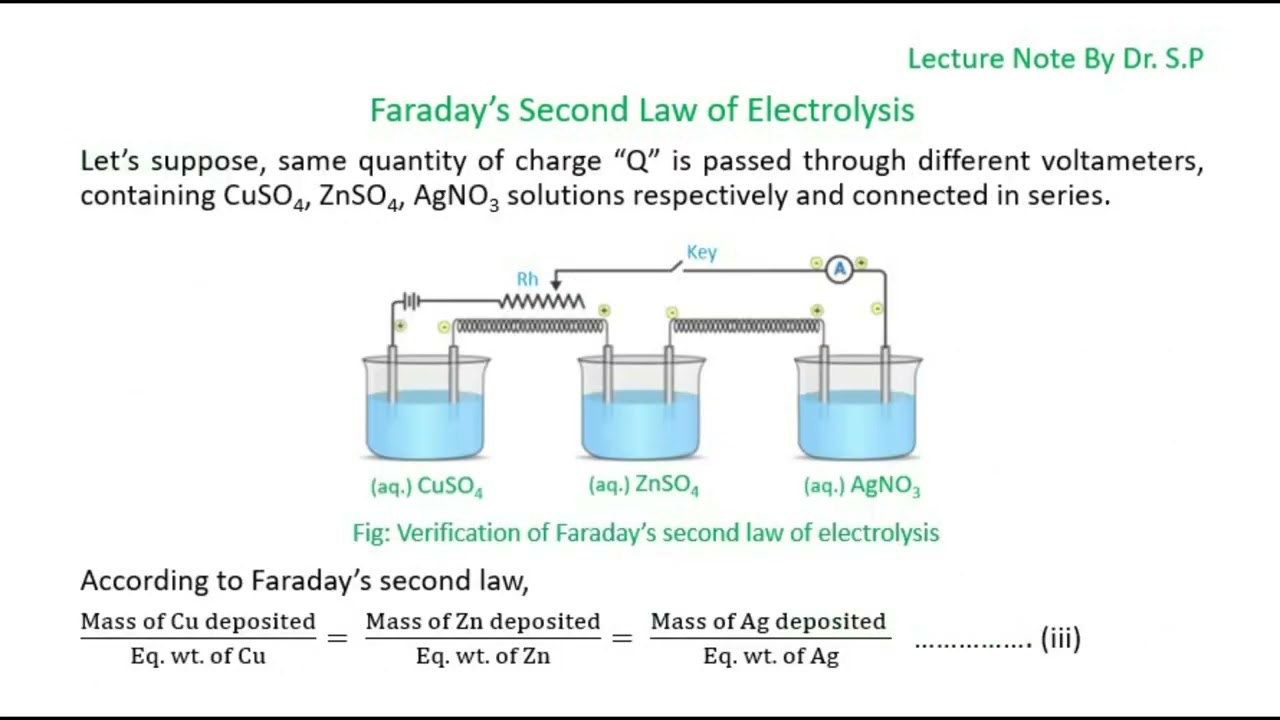
2. Hukum Faraday II
Jika dibandingkan dengan prinsip kerja yang pertama, maka prinsip kerja hukum fisika satu ini memiliki poin yang lebih menarik. Bagaimana tidak?
Prinsip kerja hukum ini berlaku pada 2 sel elektrolisis dengan kepemilikan zat yang tidak sama. Jadi, hasilnya pun juga akan berbeda dengan sebelumnya.
Hukum ini memiliki jumlah zat produk elektrolisis yang berbeda namun dapat menghasilkan jumlah yang berbanding lurus dengan massa ekuivalen dari zat-zat yang berkaitan tersebut. Bunyi dari hukum ini pun berbeda dengan hukum yang sebelumnya.
Jenis hukum ini menjelaskan tentang hasil massa zat dari proses elektrolisis akan berbanding lurus dengan massa ekuivalen dari zat yang ada di dalamnya.
Dengan begitu, hal ini membuat sebagian sel elektrolisis yang disusun berdasarkan serinya dapat memiliki jumlah muatan listrik yang sama juga.
Karena prinsip kerja yang dilakukan berbeda, tentu rumus dari hukum ini pun juga tidak sama. Berikut adalah rumus untuk menghitung prinsip kerja hukum fisika dan kimia yang kedua:
W1 / W2 = e1 / e3
Keterangan:
W1: Massa zat 1 yang tersaji dalam satuan gram
W2: Massa zat 2 yang tersaji dalam satuan gram
e1: Ekuivalen zat 1
e2: Ekuivalen zat 2
Contoh Penerapannya dalam Kehidupan Sehari-hari
Untuk memahami tentang istilah ini secara lebih dalam lagi, kami juga akan membagikan contoh penerapan hukum tersebut yang sering Anda temui dalam kehidupan sehari-hari. Berikut ini contoh penerapannya yang bisa dipelajari secara lebih lanjut lagi:
1. Pemurnian Logam Kotor
Penerapan hukum fisika dan kimia ini sudah sering dilihat pada saat proses pemurnian logam kotor di beberapa negara. Sebab, proses pemurnian logam kotor dilakukan dengan cara elektrolisis yang sama dengan hukum fisika dan kimia ini.
Cara untuk memurnikan logam kotor diawali dengan proses penyusunan logam kotor sebagai anode dan logam murni sebagai katode.
Nantinya, proses pemurnian ini dilakukan dalam larutan CuSO4 yang berperan sebagai larutan elektrolit. Setelah itu, logam tunggal murni dapat dihasilkan dari proses itu.
2. Penyepuhan Logam
Tidak hanya pemurnian logam kotor saja yang menggunakan hukum fisika dan kimia ini, tapi proses penyepuhan logam juga membutuhkan hukum tersebut. Arti dari kata penyepuhan di sini adalah pelapisan logam dengan jenis logam lainnya yang dilakukan dengan proses elektrolisis.
Tujuan dari aktivitas ini untuk melindungi suatu logam dari bahaya korosi dan membuat logam memiliki penampilan yang lebih cantik. Maka dari itu, proses penyepuhan logam seperti ini biasanya dilakukan ketika seseorang hendak membuat alat makan yang terbuat dari perak atau emas.
Contoh Soal dan Penjelasannya
Setelah memahami tentang contoh penerapannya dalam kehidupan sehari-hari, Anda juga perlu mengetahui tentang contoh soal perhitungannya yang sering muncul ketika Anda masih duduk di bangku sekolah. Berikut adalah beberapa contoh soal dan penjelasan lengkapnya:
1. Contoh Soal Pertama
Ada arus listrik berjumlah 10 ampere yang mengalirkan massa tembaga selama 9.500 detik ke dalam larutan CuSO4 (Ar Cu = 63,5). Lalu, berapa jumlah massa tembaganya?
Cu2 (aq) + 2e -> Cu(s)
ME Cu = Ar / x = 63,5 / 2 = 31,75
G = i . t / 96.500 x ME
G = 10 x 9.500 / 96.500 x 31,75
G = 31,75 gram
2. Contoh Soal Kedua
Berapa massa ekuivalen dari sebuah reaksi Cu2 + (aq) + 2e – Cu(s) jika massa tembaganya (Cu) Ar = 63,5?
Cu = ME
ME = Ar / biloks
ME = 63,5 / 2
ME = 31,75
Hukum faraday wajib diketahui oleh orang-orang yang bekerja dalam bidang kelistrikan. Namun, istilah ini juga perlu dipahami oleh orang yang bekerja di bidang lain, karena hukum fisika dan kimia ini sering dipakai dalam berbagai bidang industri lainnya. Jadi, pahami setiap poin yang ada di atas.